Vicente Bodí Peris
Catedrático de Medicina. Departmento de Medicina, Universidad de Valencia, Valencia, España
Jefe de Sección. Servicio de Cardiología, Hospital Clínico Universitario, Valencia, España
Jefe de Grupo. INCLIVA – Instituto de Investigación Sanitaria, Valencia, España
Jefe de Grupo. Centro de Investigación Biomédica en Red (CIBERCV), España
Correspondencia: Servicio de Cardiología, Hospital Clínico Universitario, Blasco Ibáñez 17, 46010 Valencia, España. Correo electrónico: vicente.bodi(at)uv.es
Hasta principios del siglo XX, la oclusión trombótica aguda de una arteria coronaria se consideraba una condición que se asociaba a una muerte de manera prácticamente inmediata1. El último siglo, y fundamentalmente los últimos 60 años, ha sido testigo de uno de los más apasionantes viajes que ha experimentado la medicina moderna. El desarrollo del desfibrilador, las unidades coronarias, los avances en prevención primaria y secundaria y sobre todo las terapias de reperfusión coronaria (primero la fibrinolisis y luego el uso generalizado de la angioplastia primaria y los stents intracoronarios) han permitido reducir de manera dramática la mortalidad aguda del infarto hasta valores en torno al 10%.
Sin embargo, en un número considerable de pacientes siguen produciéndose infartos extensos que pueden derivar con posterioridad en insuficiencia cardiaca y muerte. Un factor decisivo para entender esta observación es el hecho que, a pesar de la reperfusión aparentemente exitosa de la arteria responsable a nivel epicárdico, se puede producir un daño microvascular grave a nivel de la compleja y extensa red microvascular2,3 (Figura).
La fisiopatología de este fenómeno es multifactorial y en ella intervienen decisivamente, entre otros mecanismos, la embolización distal de material trombótico, la pérdida de integridad endotelial, el daño por isquemia-reperfusión, la vasoconstricción, la respuesta inflamatoria descontrolada y la compresión microvascular por el edema y la hemorragia tisular consecuencia de la mayor permeabilidad endotelial3,4.
La resonancia magnética cardiaca (RMC) ha sido fundamental para un mejor entendimeinto y una adecuada detección del daño microvascular tras el infarto (Figura). Este hallazgo detectado mediante RMC se conoce como obstrucción microvascular (OMV). Hasta un 50% del total de los pacientes con infarto reperfundidos y hasta un 30% de aquellos con reperfusión angiográfica de la arteria epicárdica aparentemente normal presentan OMV lo cual ejerce efectos estructurales y pronósticos deletéreos2. Estudios recientes han demostrado de manera contundente que la presencia de OMV extensa en pacientes con infarto tratados con estrategias de revascularización coronaria es uno de los predictores más potentes de remodelado adverso, insuficiencia cardiaca y muerte2,3,5.
Respecto al diagnóstico del daño microvascular, existen tanto métodos sencillos de amplia disponibilidad que orientan hacia la existencia de una deficiente reperfusión a nivel microvascular como técnicas de imagen no invasivas e invasivas que permiten confirmar y cuantificar la magnitud del daño2,3.
Respecto a los métodos sencillos de amplia disponibilidad, algunos indicadores indirectos serológicos como un mayor pico de enzimas de necrosis y una mayor elevación de leucocitos (especialmente de la ratio neutrófilos/linfocitos) son marcadores no definitivos pero que, dado que son analizados de manera universal y secuencial, constituyen una primera señal de alarma para el diagnóstico3. Se han descrito recientemente nuevos marcadores serológicos específicos de daño microvascular que pueden ser útiles para el diagnóstico, pero sobre todo para avanzar en el entendimiento de la fisiopatología de este fenómeno6. En cualquier caso, el electrocardiograma es la herramienta fundamental y precoz en este escenario de sospecha3. En concreto, un ascenso persistente del segmento ST tras la revascularización ayuda a predecir de manera inmediata una mayor probabilidad de daño microvascular.
Respecto a las técnicas de imagen no invasivas, la ecocardiografía transtorácica con inyección intracoronaria o intravenosa de contraste ecográfico supuso inicialmente un gran avance para demostrar la presencia de defectos de perfusión miocárdica. En cualquier caso, la interpretación de los estudios requiere gran experiencia y las imágenes en no pocos casos no son óptimas3. Por ello, la aportación de la RMC fue un hito decisivo.
En la actualidad, el análisis mediante RMC de las secuencias de realce tardío de gadolinio representa el método de referencia para diagnosticar y cuantificar la OMV2,3,5. Unos minutos después de la inyección de contraste, el gadolinio desaparece del miocardio. La persistencia de la captación tardía de contraste permite una delimitación precisa del área infartada, mientras que la falta de contraste en la región central del territorio infartado identifica la presencia de OMV (Figura)2,3,5. Otros métodos derivados de la RMC tales como el retraso de la llegada a la zona infartada durante el primer paso tras la inyección del contraste (muy sensible pero poco específica de daño microvascular grave) o la cuantificación del flujo miocárdico (pendiente de validación) son alternativas a la valoración de la OMV mediante secuencias de captación tardía3.
En cuanto a las técnicas de imagen invasivas, existen diversos índices angiográficos visuales y semicuantitativos de fácil aplicación utilizados tradicionalmente en el laboratorio de hemodinámica sin prolongar los estudios. Sin embargo, hasta un 30% de pacientes con flujo aparentemente normal en la arteria coronaria tras la revascularización presentan una deficiente reperfusión en comparación con una técnica de referencia como la RMC2,3. Más recientemente se han descrito nuevos índices derivados del cateterismo cardiaco que permiten una fiable valoración de la microcirculación mediante la cuantificación del flujo o la resistencia microvascular2,3. Su cuantificación en el laboratorio de hemodinámica hace necesario prolongar los estudios en pacientes ya de por si complejos y en situación de inestabilidad clínica. Todo ello hace que, a pesar de su fiabilidad, su uso rutinario en el análisis del daño microvascular tras el infarto sea escaso.
Junto a los avances en las técnicas diagnósticas, fundamentalmente la RMC, los modelos experimentales (fundamentalmente el porcino3) han permitido hacer avances decisivos en el conocimiento de la dinámica y la fisiopatología del daño microvascular tras un infarto (Figura). En este sentido, existen 3 puntos básicos que han de fundamentar eventuales avances hacia la búsqueda de futuras oportunidades terapéuticas dirigidas a la resolución o atenuación del daño microvascular post-infarto:
- La reperfusión es el punto crítico tanto para salvar miocardio como microcirculación2,3,5. Un mayor retraso disminuye dramáticamente la probabilidad de recuperación. Más aún, este es el momento clave en el potencial daño por isquemia-reperfusión y en la aceleración del daño microvascular. En este punto, la logística de traslado de los pacientes (código infarto) y un exquisito abordaje técnico y médico en el laboratorio de hemodinámica juegan un papel central.
- La onda del daño microvascular presenta una progresión mucho más lenta (llega a su pico de extensión varios días después de la reperfusión) que la de necrosis en los cardiomiocitos3. Esto ofrece de entrada una ventana de tiempo potencialmente más larga (en comparación con las escasas 4-6 horas disponibles para salvar el miocardio) en la que podrían actuar futuras terapias coadyuvantes dirigidas a reparar el daño microvascular7.
- Existe una tendencia natural, tanto en modelos experimentales como en pacientes con infarto seguidos secuencialmente con RMC, a la reparación espontánea de la microcirculación durante las semanas y meses siguientes al infarto2,3. Esta tendencia a la regeneración espontánea microvascular se contrapone a la prácticamente nula regeneración miocárdica y constituye una respuesta natural de nuestro organismo que, adecuadamente entendida y modulada, puede representar un atractivo objetivo terapéutico en el futuro.
Tras un esfuerzo investigador de décadas, los avances en regeneración miocárdica tras el infarto han sido modestos. En contraposición, la regeneración microvascular se presenta como una tendencia natural de nuestro organismo mediada por una orquestada respuesta natural dirigida hacia la neoangiogénesis3,6,7. Esta dinámica apunta hacia que un mejor conocimiento del proceso de daño microvascular puede conducir en el futuro al uso de terapias de modulación y aceleración controlada de la reparación microvascular en aquellos pacientes que se pueden beneficiar más, esto es, aquellos con daño microvascular grave. Muy probablemente la manera más segura y efectiva de administración de eventuales terapias coadyuvantes a la reperfusión será su liberación selectiva en el centro de la zona de daño miocárdico y microvascular mediante cateterización selectiva.
La pregunta pendiente es qué productos o estrategias coadyuvantes a la reperfusión serán efectivos en la práctica rutinaria para completar el apasionante viaje que, durante algo más de un siglo, ha conducido a mejorar el pronóstico de los pacientes con infarto. Como prueba de concepto, existen datos preliminares que sugieren que medidas de potenciación selectiva del proceso de reparación del daño microvascular podrían ayudar a la reperfusión en los objetivos de salvar miocardio y reparar la microcirculación7. Sin embargo, la traslación a la clínica de este tipo de aproximaciones requerirá todavía intensos esfuerzos de investigación. Mientras tanto, la potenciación y generalización de la educación cardiovascular, las medidas de prevención primaria y las estrategias de reperfusión precoz nos permitirán consolidar todo el camino recorrido.
BIBLIOGRAFÍA
- Herrick JB. Thrombosis of the coronary arteries. JAMA 1919;72:387-390.
- Konijnenberg LSF, Damman P, Duncker DJ, et al. Pathophysiology and diagnosis of coronary microvascular dysfunction in ST-elevation myocardial infarction. Cardiovasc Res 2020;116:787-805.
- Rios-Navarro C, Marcos-Garces V, Bayes-Genis A, Husser O, Nuñez J, Bodi V. Microvascular Obstruction in ST-Segment Elevation Myocardial Infarction: Looking Back to Move Forward. Focus on CMR. J Clin Med 2019;8:1805.
- Kloner RA, Ganote CE, Jennings RB. The «no-reflow» phenomenon after temporary coronary occlusion in the dog. J Clin Invest 1974;54:1496-1508.
- Ibanez B, Aletras AH, Arai AE, et al. Cardiac MRI Endpoints in Myocardial Infarction Experimental and Clinical Trials: JACC Scientific Expert Panel. J Am Coll Cardiol 2019;74:238-256.
- Ríos-Navarro C, Gavara J, Núñez J, et al. EpCAM and microvascular obstruction in patients with STEMI: a cardiac magnetic resonance study. Rev Esp Cardiol 2022;75:384-391.
- Ríos-Navarro C, Hueso L, Díaz A, et al. Role of antiangiogenic VEGF-A165b in angiogenesis and systolic function after reperfused myocardial infarction. Rev Esp Cardiol 2021;74:131-139.
Figura
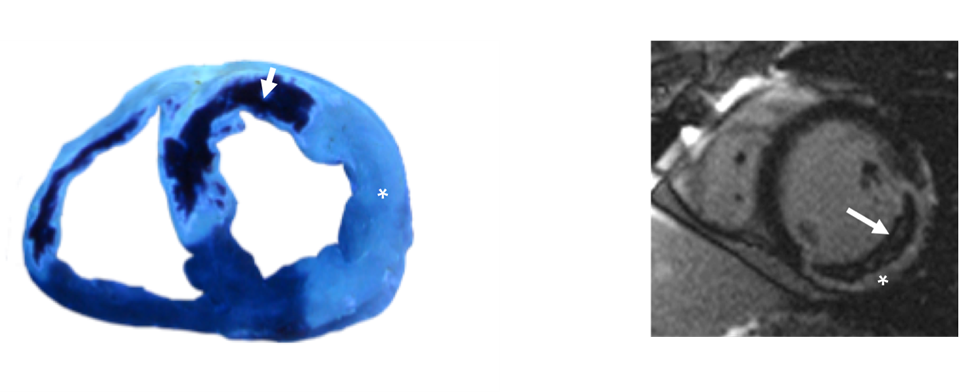
– Izquierda: Sección de un modelo experimental porcino con infarto anterior reperfundido provocado por la oclusión transitoria de la arteria descendente anterior. Se inyecta por vía intracoronaria el colorante tioflavina S. La zona bien reperfundida capta el colorante (asterisco). La zona con daño microvascular a pesar de la reperfusión coronaria no capta tioflavina (flecha).
– Derecha. Corte transversal de un estudio de resonancia magnética cardiaca en un paciente con infarto inferior provocado por la oclusión trombótica de la arteria coronaria derecha que fue reperfundido mediante angioplastia primaria y stent intracoronario. Se inyecta de manera intravenosa el colorante gadolinio. La zona infartada capta gadolinio (asterisco). El centro de la zona infartada presenta un severo daño microvascular que impide la entrada del colorante (flecha).
 Newsletter
Newsletter Contacto
Contacto