
César Nombela.
Catedrático emérito de Microbiología. Fundación QUAES
Hemos de seguir evocando un escenario que condiciona la historia de la humanidad en estos momentos: nos remite siempre a la ciudad china de Wuhan, aproximadamente en Diciembre de 2019. La metáfora, ampliamente utilizada, de que algo se ha “hecho viral” para aludir a lo que se difunde y generaliza con rapidez, cobra materialidad física-biológica en forma de virus real en aquel lugar geográfico. Emerge un virus que se había de “hacer viral”, valga la redundancia, causando una pandemia que la Organización Mundial de la Salud (con notable tardanza) hubo de declarar el 11 Marzo de 2020.
La exploración científica de la historia natural del virus, muy pronto denominado taxonómicamente SARS-CoV-2, así como su interacción con el hospedador humano para producir la COVID-19, ha ido dando resultados a la altura de lo que los tiempos permiten. La secuencia de las 30.000 bases que integran la cadena única de RNA que constituye el material genético del virus; las catorce proteínas a que da lugar cuando se adueña de las funciones de la célula a la que infecta; la patología en humanos no sólo respiratoria que afecta a los casos más graves; la respuesta inmunitaria, en fin, que puede generar en el paciente infectado. Todo ello constituye hoy un cuerpo de doctrina científica apoyada por infinidad de investigaciones encaminadas a combatir la infección con las correspondientes terapias, curativas y preventivas.
En este sentido de la prevención, la palabra vacuna se convierte en el talismán con el que conjurar los peligros sanitarios, que alcanzan a todos los rincones del globo, así como salvar vidas y empleos. Para su descubrimiento y desarrollo, en medio de un esfuerzo sin precedentes, se han planteado procedimientos que superan los paradigmas más establecidos.
La clásica secuencia obligada para desarrollar vacunas comenzaba siempre con una detallada experimentación preclínica en animales. Un paso imprescindible para proseguir con pruebas en humanos; las fases I y II, que han de demostrar la seguridad del producto vacunal y la fase III, ensayos de campo con los que probar la eficacia vacunando a miles personas.
En el desarrollo de la vacuna contra la COVID-19, más bien de las vacunas porque hay muchas en este proceso, se han solapado con frecuencia la experimentación preclínica con las pruebas iniciales en humanos, y el diseño de la fase III con el desarrollo de etapas I y II . Ello ha sido posible tanto por la incorporación valiosa de experiencias previas, como son desarrollos anteriores frente a coronavirus muy parecidos, como por un análisis ético y científico de muchas propuestas, que permitió autorizar ensayos de manera razonable.
Gracias a todo este esfuerzo en estos momentos se documentan más de 90 tipos de vacunas en investigación preclínica activa y unas 40 ya en experimentación clínica en humanos en diferentes fases . Iniciativas internacionales como CEPI (Coalition for Epidemics Preparedness Innovation) o COVAX (COVID-19 Vaccines Global Access) avanzan esfuerzos para asegurar un acceso de todos a las vacunas que se desarrollen.
Una pregunta fundamental es si cabe pensar que para este virus se puede lograr pronto un producto antigénico vacunal que dé lugar a una respuesta inmunitaria robusta, eficaz y duradera en los vacunados. Numerosas observaciones mueven a la esperanza, como el que muchos pacientes desarrollan una respuesta inmunitaria con un buen nivel de anticuerpos, lo que se trata de aprovechar empleando plasma de convalecientes para tratamientos. Las pruebas en fases iniciales de la vacunas en estudio indican igualmente una buena respuesta de anticuerpos, una estimulación de inmunidad celular por linfocitos T así como una presencia de memoria inmunitaria por linfocitos B. Altamente sugerente, resulta el que se haya observado una cierta protección frente a SARS-CoV-2 por reacción cruzada con anticuerpos inducidos por los coronavirus catarrales, de los que conviven con nosotros habitualmente.
No obstante, habrá que despejar cuestiones como la duración de la respuesta inmunitaria, los niveles de anticuerpos necesarios para proteger frente al virus. La duración de esta respuesta en algunos casos parece limitarse a tres meses. Permanece como una incógnita aun lo que pueda significar los casos observados de reinfección, y cómo de frecuente puede ser el fenómeno.
Pendientes de despejar estas interrogantes, la investigación prosigue utilizando un buen número de plataformas de posibles vacunas. Algunas de estas cubren opciones de vacunación ya muy establecidas como:
(i) vacunas integradas por el coronavirus SARS-CoV-2 inactivado, como sucede con las vacunas en uso frente hepatitis A, gripe, polio o rabia o vacunas con este mismo virus vivo atenuado, la opción que utilizan las vacunas frente a sarampión, parotiditis, rubeola, viruela, fiebre amarilla;
(ii) (ii) vacunas a base de antígenos de SARS-CoV-2, siempre como mínimo a partir de preparaciones de la proteína S (la que constituye las protuberancias) que le dan aspecto de corona. Responderían al modelo de vacuna empleada ya para Hepatitis B, virus papiloma humano, neumococo, meningococo, Haemophilus b.
(iii) vacunas en el que el antígeno (proteína S) se administra vectorizado en otro virus, como algún tipo de adenovirus catarral, replicativo o no replicativo, que sirve para introducir dicho antígeno en el organismo a vacunar. Es una estrategia muy interesante utilizada en experimentación, pero aún no hay vacunas sectorizadas que estén en uso.
(iv) vacunas integradas por ácido nucleico vírico, ya sea RNA o su DNA complementario, que introducido en el organismo pueda codificar el antígeno vírico (proteína S) y desencadenar una respuesta inmunitaria. Como en la anterior, se trata de una plataforma vacunal muy interesante pero que aún no está en uso en ninguna de las vacunas utilizadas en la práctica.
Con este panorama nos encontramos que nueve de las opciones en desarrollo están ya en fase III de experimentación clínica. Se indican en la Tabla siguiente:
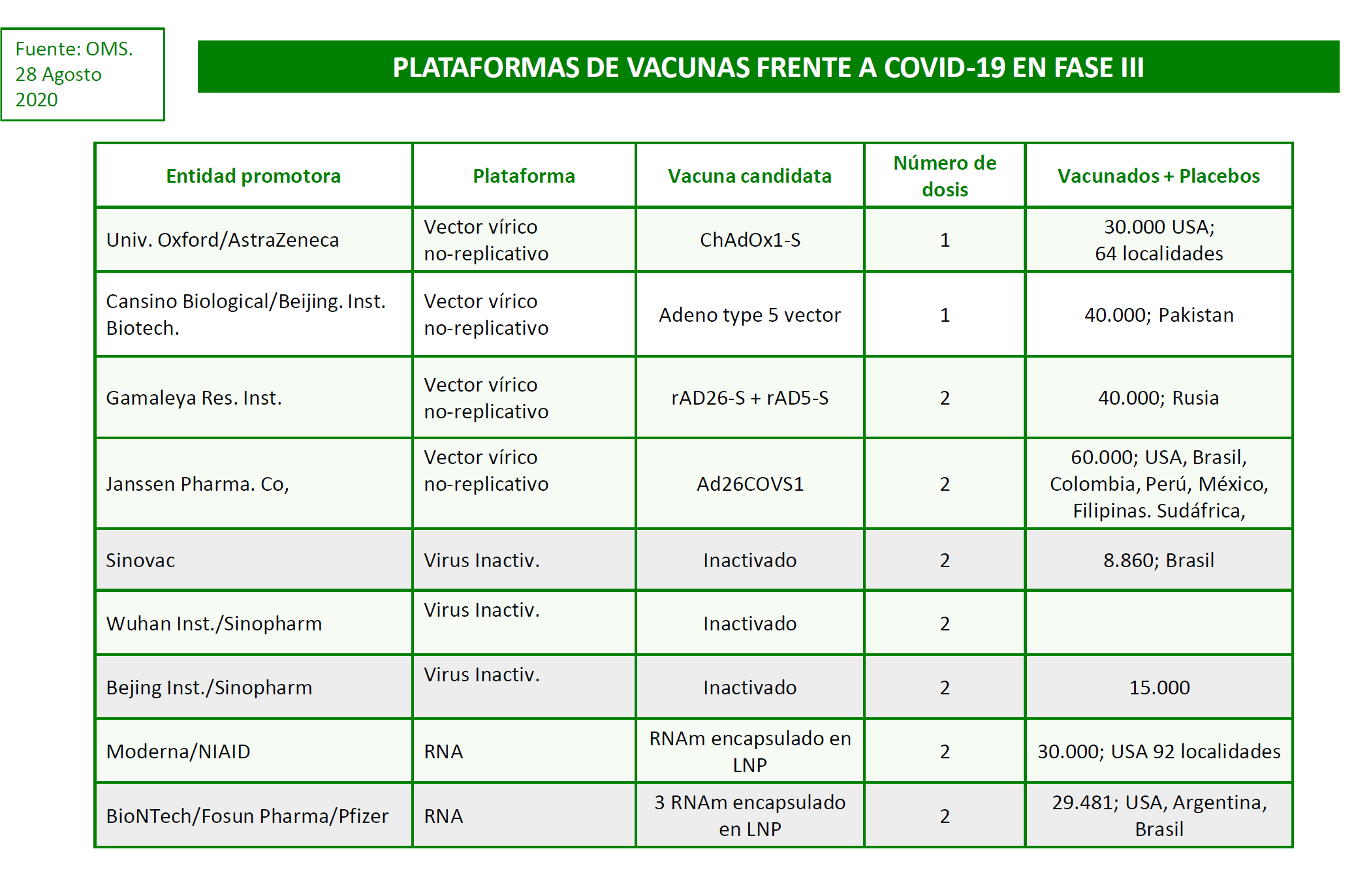
La decisiva fase III supone vacunar al menos 30.000 voluntarios, al tiempo que utilizar la vacuna o un producto placebo con dicho propósito. Se trata de ensayos doble ciego y aleatorizados, que se realizan en lugares de transmisión activa de la infección. Es la forma exigida para demostrar la eficacia medida entre otras cosas como porcentaje de los vacunados que se protegen frente a la infección de alguna de las formas establecidas.
Los criterios clínicos de validación (end-points) en vacunados y placebos pueden ser el de Infección confirmada (primario) o infección grave (secundario). La respuesta inmunitaria determinada en laboratorio (anticuerpos, inmunidad celular) podrá ser un buen biomarcador pero no sustituye a la protección frente a la infección clínica.
A pesar de lo avanzado de estos trabajos, persisten preguntas que han de irse despejando en la próximas fechas y que se refieren al trabajo de las agencias regulatorias, las que se encargarán de la aprobación de la correspondiente vacuna si procediera. Dando por sentado que lograr el 100% de eficacia es imposible, cabe el que una vacuna eficaz en el 50% sea aprobada. Lo cual indica que podrá haber vacunas de distinta eficacia, incluso en etapas de estudio y experimentación. La urgencia de disponer de la vacuna puede llevar a las autoridades regulatorias a otorgar pre-licencias, por ejemplo cuando se haya completado el estudio para 3000 participantes. La cuestión de la coexistencia de varias vacunas en el mismo sitio así como el efecto protector que puedan tener, ya sea inmunidad esterilizante (el virus no infecta) o protección frente a la infección grave, son cuestiones que nos acompañarán en relación con la vacuna frente a COVID-19.
Como comentario final, cabe señalar que a pesar del gran esfuerzo en marcha para desarrollar vacunas, que nos protejan de una pandemia tan global que nadie ni en los más recónditos lugares de mundos se libra de este riesgo, las respuestas definitivas todavía están pendientes. Las autoridades regulatorias tienen muy claro que autorizar vacunas sin una demostración final de su seguridad y eficacia sería muy contraproducente. Igualmente está claro que la fabricación en gran escala con la mayores exigencias de la calidad –hablamos de miles de millones de dosis- no es una cuestión baladí. Apuntamos a un futuro no muy lejano, en el que el uso de varias vacunas nos llevará a esa fase IV de estudios de medicamentos, en la que su uso consolidado y generalizado, demanda una permanente farmacovigilancia para asegurar que lo que en su día se autorizó sigue siendo un tratamiento preventivo, seguro y eficaz.
1)Lurie, M et al. DOI: 10.1056/NEJMp2005630
2)Thang Le et al. Nat. Revs. Drug. Discov. 19, 305 (2020)
Dejar Comentario
 Newsletter
Newsletter Contacto
Contacto




